1. Электрохимическая реакция
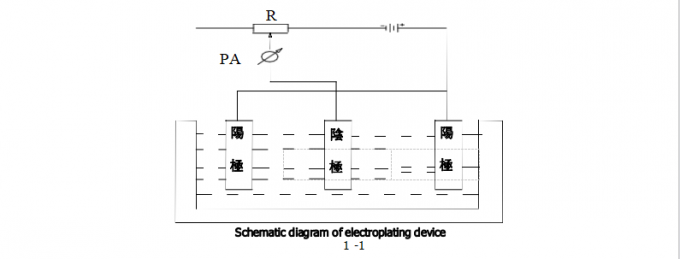
Диаграмма ниже схематическая диаграмма гальванизируя прибора. Часть, который нужно покрыть катод, который соединен с отрицательным поляком электропитания DC. Анод металла подключен с положительным поляком электропитания DC. И анод и катод погружены в покрывая решении. Когда некоторый потенциал приложен между катодом и анодом, следующая реакция происходит на катоде: ион Mn+ металла отразил от внутренности покрывая решения к интерфейсу между электродом и покрывая решением получает электроны n от катода и уменьшает к металлу m с другой стороны, на аноде после этого совершенно противоположная реакция к катоду происходит, т.е., растворение металла m происходит на интерфейсе анода, и электроны n выпущены для генерации ионов Mn+ металла.
2. Закон Фарадея
Когда настоящие пропуски через покрывая решение, электролитическая реакция происходят в решении электролита, металл на катоде непрерывно осажден, и металл анода непрерывно растворен. Поэтому, количество осадков (или растворение) металла необходимо связать с обязанностью проходя до конца. Основанный на большое количество экспириментально результатов, Фарадей установил закон отношения между осажденным (или растворил) веществом и электрическим зарядом.
Закон Farah первый: Вес осажденного (или растворил) вещества на электроде пропорциональн к обязанности проведенной до конца во время электролитической реакции, этого является следующим: m=kQ=kIt (m масса осажденного или растворенного вещества на электроде; Q проведенная обязанность когда; K пропорциональная константа; Я настоящие; t время наэлектризованности.
Закон Фарадея вторых: В различных электролитах, когда то же самое количество обязанности проведено, количество вещества которое осаждает (или растворяет) на электроде равно, и количества обязанности необходимо, что осадило (или растворить) 1mol любого вещества равно к нему 9.65X104C. Эта константа вызвана Фарадеем постоянн, представленный f, K=M/F.
3. Выход на токе
Во время гальванизировать, масса вещества фактически осадила на катоде не равна к результату вычисления полученному согласно закону Farah, и натуральная величина всегда более небольшая чем расчетная величина. Это связано с тем что больше чем одна реакция на электроде. В дополнение к главной реакции, бортовые реакции также происходят.
4. Способность рассеивания покрывать решение
Способность рассеивания покрывая решения ссылается на способность гальванизируя решения равномерно распределить толщину слоя металла, также известную как бросая способность. Лучший способность рассеивания гальванизируя решения, равномерный толщина слоя металла депозированного на различных частях катода.
5. Охват покрывать решение
В гальванизируя продукции, другая концепция обыкновенно использовала способность охвата, также известная как глубокая покрывая способность, которая ссылается на способность гальванизируя решения депозировать покрытие металла на глубоких гнездах покрытых частей. Способность рассеивания и способность покрывать другие. Бывшее вопрос как равномерный металл распределен на поверхности катода. Своя предпосылка что покрытие на поверхности катода; пока последнее ссылается на проблему депозирован ли металл на глубоких гнездах поверхности катода.

 Ваше сообщение должно содержать от 20 до 3000 символов!
Ваше сообщение должно содержать от 20 до 3000 символов! Пожалуйста, проверьте свою электронную почту!
Пожалуйста, проверьте свою электронную почту!  Ваше сообщение должно содержать от 20 до 3000 символов!
Ваше сообщение должно содержать от 20 до 3000 символов! Пожалуйста, проверьте свою электронную почту!
Пожалуйста, проверьте свою электронную почту! 

